Вчера, приехав домой с работы увидел комментарий Руслана Иванюшина, автора известного сайта Amania, на мой пост о Бликсе японской, как индикаторе Fe2+. Скажу честно, этим фактом я был приятно удивлен, поскольку регулярно просматриваю его сайт. Как только я собрался прокомментировать сообщение Руслана, он его удалил… Поэтому, решил приехав на работу ответить ему частным образом по e-mail. Однако, обнаружил еще одно сообщение, которое является редакцией первого. Подумав, что эта тема может быть интересной читателям моего дневника, решил дать развернутый (насколько позволяет время) ответ на комментарии Руслана.
В начале приведу сообщения которые оставил Руслан, для того, что бы было понятно о чем идет речь.
Первый комментарий Руслана (удаленный):
naman прокомментировал(а) ваше сообщение "Blyxa japonica – индикатор Fe2+":
"Считается, что концентрация Fe2+ должна быть ~0.1 мг/л и тогда растения будут хорошо расти."
Не совсем так.
Fe=0.1мг/л это минимальная дозировка.
И это НЕ концентрация в воде.
И не Fe2+, а просто Fe.
В хелатных комплексах железо ВСЕГДА в форме Fe3+, и прекрасно используется растениями.
Теоретически возможно связывание железа хелатами в форме Fe2+, но на практике такого не происходит (мнение Greg Morin, Seachem). Это же говорят производители хелаторов.
Fe2+ ТОЛЬКО в глюконате железа, и действительно легче усваивается растениями, но при много света+много CO2+много микро и макро это абсолютно не критично. На десять порядков важнее какой хелатор используется, удерживает ли он железо в воде вашей жесткости/pH.
Глюконат железа обычно используют как «скорую помощь» при хлорозе от недостаточной дозировки других препаратов, или если вода жесткая, а микроэлементов на сильном хелаторе нет.
Кроме того ув. Сергей здесь перепутаны понятия "дозировки в неделю" и "концентрации вещества в воде" - устоявшейся концентрации элемента в конкретном аквариуме после влияния потребления растениями, подмен воды, окисления, связывания субстратом и пр. влияний.
Можно даже вносить Fe 0.1мг/л ежедневно (напр. после хлороза) и оно не будет определятся тестами (подразумеваю что используется сильный хелат для данной воды).
Минимальная дозировка Fe 0.1мг/л в неделю, обычно при подаче CO2 этого не достаточно, и вносят 0.3-0.5 и даже 0.7мг/л в неделю.
p.s.
так держать!
Комментарий заканчивается позитивным “так держать”, собственно в этом позитивном ключе я и буду давать ответ :-) Однако, через несколько часов настроение у Руслана изменилось и на свет появилась более жесткая и бескомпромиссная редакция. Привожу ее ниже, на случай если Руслан и ее удалит.
Второй комментарий:
naman прокомментировал(а) ваше сообщение "Blyxa japonica – индикатор Fe2+":
"Считается, что концентрация Fe2+ должна быть ~0.1 мг/л и тогда растения будут хорошо расти."
1) Fe=0.1мг/л всегда указывается как минимальная дозировка в неделю.
И это НЕ концентрация в воде.
Здесь перепутаны понятия "дозировки в неделю" и "концентрации вещества в воде" - устоявшейся концентрации элемента в конкретном аквариуме после влияния потребления растениями, подмен воды, окисления, связывания субстратом и пр. влияний.
Можно даже вносить Fe 0.1мг/л ежедневно (напр. после хлороза) и оно не будет определяться тестами (подразумеваю что используется сильный хелат для данной воды и точный тест JBL).
Минимальная дозировка Fe 0.1мг/л в неделю, обычно при подаче CO2 этого не достаточно, и вносят 0.3-0.5 и даже 0.7мг/л в неделю.
2) И не Fe2+, а просто Fe.
В хелатных комплексах железо ВСЕГДА в форме Fe3+, и прекрасно используется растениями.
Теоретически возможно связывание железа хелатами в форме Fe2+, но на практике такого не происходит (мнение Greg Morin, Seachem). Попытки приготовить с Трилоном Б (EDTA) раствор с Fe2+ является полным абсурдом. Fe2+ ТОЛЬКО в глюконате железа, и действительно легче усваивается растениями, но при много света+много CO2+много микро и макро это абсолютно не важно. Критично то удерживает ли хелатор железо в воде вашей жесткости/pH. Глюконат железа обычно используют как «скорую помощь» при хлорозе от недостаточной дозировки микроэлементов, или если вода жесткая, а микроэлементов на сильном хелаторе нет. Незнание таких простых вещей приводит к бесконечному поиску «двухвалентного железа»…
Все это давно и очень подробно рассказано на моем сайте Amania.
Скажу сразу, что blogger настроен отсылать новые комментарии на мой почтовый ящик. Так мне удобней следить за активность в блоге. По этому, даже если комментарий удален, он у меня сохраняется в почтовом ящике, и ни каких специальных шпионских хитростей тут нет :-)
Ну что же, после длительно вступления пора приступать к делу.
Начну с того, что этилендиаминтетроуксусная кислота (EDTA) малорастворима в воде и для получения комлексов с металлами используется ее натриевая соль Na4(EDTA), которая в воде хорошо растворима, и называется Трилон Б или комплексон III.
Комплекс Fe(II)-EDTA приготавливают из Fe2SO4*7H2O и Na4(EDTA) с незапамятных времен, о чем подробно освещено в научной литературе. Например, подробно исследован процесс окисления Fe(II)-EDTA-->Fe(III)-EDTA молекулярным кислородом в водных растворах в статье “Kinetics of [FeII(edta)] Oxidation by Molecular Oxygen Revisited. New Evidence for a
Multistep Mechanism”, и такой литературы, как говорится “пруд-пруди”.
Так же существуют и более утилитарные области применения Fe(II)-EDTA, например для удаления токсичного моноксида азота из водных растворов, о чем можно прочитать в соответствующей работе.
Добавлю, что подавляющее большинство методик определения содержания общего железа основаны на восстановление Fe3+ до Fe2+ с образованием цветных комплексов. Например, способ используемый в тестах JBL и Sera на обнаружение Fe в аквариумной воде основан на образовании комплекса Fe2+ с 2,2’-дипиридилом, окрашенного от бледно-розового до красного цветов, в зависимости от концентрации Fe2+ в исследуемом растворе.
2,2’-дипиридил – распространенный реагент, и у меня есть в планах сделать DIY-тест на железо и опубликовать результаты в блоге.
Ну и последнее доказательство практического существования Fe(II)-EDTA.
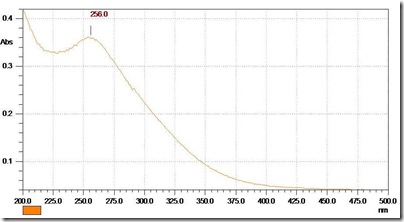
Ниже приведен спектр в UV/Vis –диапазоне свежего раствора Fe(II)-EDTA, полученные на спектрофотометре Uvicon 943.
Спектр мне нужен был для изучения возможности протекания фотолиза Fe(II)-EDTA под действием излучения ультрафиолетового стерилизатора, в общем эта работа закончена и со временем результаты опубликую в блоге.
Думаю, доказательства существования Fe(II)-EDTA исчерпывающие, и абсурд исходит с Вашей стороны Руслан!
Теперь разберемся, что происходит с комплексом дальше. В приведенной выше статье это подробно рассмотрено. Происходит окисление Fe(II)-EDTA до Fe(III)-EDTA по следующей схеме:
Таким, образом постепенно, не мгновенно, весь Fe(II)-EDTA переходит в Fe(III)-EDTA, возможно именно это и имел в виду Greg Morin из Seachem. Относительно того в какой форме железо легче усваивается растениями сказать не могу – поскольку этот вопрос еще не изучал. Руслан, если у Вас есть конкретные научные публикации по этой теме, буду благодарен Вам за них. Ну а если нет, то думаю, изучу этот вопрос когда буду посвободнее и результаты опубликую в блоге.
Таким образом, концентрированный раствор Fe(II)-EDTA с плотно закрытой пробкой, может храниться продолжительное время, поскольку концентрация растворенного кислорода в растворе не велика по сравнению с концентрацией самого комплекса. Поэтому, добавляя удобрение из холодильника (имеется ввиду “самомес”), мы гарантированно вносим в аквариум именно двухвалентное железо, а то, что не успели потребить растения, конечно окислится до Fe(III), но это как говорится уже другая песня…
Теперь по поводу концентрации и дозировок железа в воде. Хочу только процитировать фрагмент текста из Вашего (Руслан) сайта “…За это время концентрация железа Fe установится на минимальном уровне 0.1мг/л. Если после этого будет наблюдаться хлороз, пересчитайте дозу по Fe на больше чем 0.1мг/л, но не более чем на 0.7мг/л…” из раздела под названием “Fe2”. Больше мне добавить по этому поводу нечего….
Хочу предвосхитить возможные вопросы на счет своей компетенции в обсуждаемых областях. Я конечно работаю не в Seachem, а в простой Российской академии наук в Институте химии нефти СО РАН, обычным старшим научным сотрудником, но это мне позволяет анализировать соответствующую литературу и делать скромные выводы, которые я и отразил в этом продолжительном сообщении.
И еще, полагаю, что аквариумистика, это все таки хобби (удовольствие), а не площадка для баталий, и Вам, Руслан, предлагаю спокойней относится к мнению других любителей, тогда, возможно, совместными усилиями удастся еще больше развить теорию и практику аквакультуры.
P.S. Прошу извинения за возможные опечатки, т.к. то, что написал просматривал “одним глазом”.

:) вообще, жесткость во взглядах на аквариумное хобби не новА. Но жесткие дискуссии часто, если не всегда, проливают много света на сложные темы, и особенно на вопросы химии, физики. Достаточно мало специалистов из этих областей в аква-теме, в основном, все мы - хоббисты, которые "вооружены" школьным уровнем таких знаний (как я, например), ну может еще чуть самообразования ;) и чисто интиутивно приходим к тем вещам, о которых профи наверняка знают неизмеримо больше. И важно, чтоб такая, проф информация была изложна вот так, доходчиво и понятно. Да, аквариум действительно хобби, которое объединяет людей очень разных профессий. Сергей, спасибо Вам за то, что пишите :) ПишИте, пожалуйста. :) Очень интересно и полезно читать Вас.
ОтветитьУдалитьНаташа! Спасибо за теплые слова :-) Как говорится "Дьявол кроется в деталях", по этому считаю интуитивный подход самым верным способом вырастить красивый подводный сад, ну и надводный тоже :-)Знания конечно не помешаю, но интуиция должна идти на первом месте. Пользуясь случаем поздравляю Вас с наступающим 8 марта! Желаю весеннего настроения, и цветов каждый день!
ОтветитьУдалитьСергей, очень полезная инфа. Но я перестал применять трилон, таки мне кажется что он плохо держит железо в 2х валентной форме, но это чисто интуитивно:) Да и сернокислое железо быстрее окисляется и желтеет, одна морока:) Что казается концентрацияй 0,1 это конечно ни в какие ворота не лезет:)
ОтветитьУдалитьСергей, а Вы что применяете? У меня, видимо, попалась удачная партия сернокислого железа, желтеть начала только через 1,5 года...
ОтветитьУдалитьЯ вот это лью, результатом очень даволен. Ну естественно отдельно соли в осмос и калий.
ОтветитьУдалитьhttp://mironovich.blogspot.com/2009/01/plantex-csmb.html
Пробовал в состав замешивать сразу калий, выпадает в осадок к сожалению.
Хорошая смесь, но у меня для "самомеса" ингредиентов на 100 лет вперед :-)
ОтветитьУдалитьnata_boa
ОтветитьУдалить«…Очень интересно и полезно читать Вас.»
…не нужно быть лингвистом чтобы понять что здесь в явной форме высказана мысль что приятно читать г-на Кудряшова… и неприятно читать naman :)
Мне очень хорошо и давно знакомо, что означают подобные «нюансы» построения фраз, люди их выстраивающие, их среда, поименный список в этом хобби, и какова их цель.
nata_boa
«… И важно, чтоб такая, проф информация была изложена вот так, доходчиво и понятно.»
Я вас сильно разочарую относительно сего «ученого».
сдаю зачет...
ОтветитьУдалитьhttp://www.amania.110mb.com/Chapters/Tech/marginal2.html
В первую очередь хочу высказать благодарность обоим авторам за данную дискуссию! Ведь в споре рождается истина! (с) Жаль что не у всех хватает навыков вести дискуссию что нередко заканчивается подобными недоразумениями. И по сему, хотелось бы пожелать обоим авторам поменьше хамства и побольше терпимости по отношению к собеседнику.
ОтветитьУдалитьИ еще раз огромное спасибо за ваши труды. Так держать!
С Ув., RUS
Здравствуйте, Руслан! Спасибо! Полностью с Вами согласен. Однако, по-моему, хамства с моей стороны не было. Хотя, опять же, со стороны виднее будет :-)
ОтветитьУдалить